





Данный сайт содержит
профессиональную специализированную информацию
Согласно действующему законодательству, данные материалы могут быть доступны только медицинским работникам. Я подтверждаю, что являюсь специалистом с медицинским образованием, и информация, полученная на сайте, будет использована мною только в профессиональной деятельности.



Дальнейшее использование Вами сайта означает принятие Условий его использования, либо Вам следует покинуть сайт. Сайт может использовать файлы cookie и аналогичные технологии для взаимодействия с Вами. Вы можете согласиться на использование cookie, нажав кнопку «Соглашаюсь» или заблокировать их использование, изменив настройки вашего интернет-браузера.
Дальнейшее использование Вами сайта означает принятие Условий его использования, либо Вам следует покинуть сайт. Сайт может использовать файлы cookie и аналогичные технологии для взаимодействия с Вами. Вы можете согласиться на использование cookie, нажав кнопку «Соглашаюсь» или заблокировать их использование, изменив настройки вашего интернет-браузера.
Клинические исследования препарата Тедуглутид
- EMA Press Release 2012. EMA/CHMP/409283/2012.
- Адаптировано из Шеменкова В.С. Принципы ведения больных с синдромом короткой кишки. Медицинский Совет. 2023;(23):144-148. https://doi.org/10.21518/ms2023-490.
- Pironi L, Arends J, Bozzetti F, et al. Clin Nutr. 2016;35(2):247-307.
- Jeppesen PB, et al. Gastroenterology 2012;143:1473-81 e3. 2. teduglutide EMA Summary of Product Characteristics, Shire Pharmaceuticals Ireland Limited. February 2019. Согласно базе данных grls.ru по состоянию на 29.07.2024.
- Jeppesen PB, et al. Gastroenterology. 2012;143:1473-81 e3.
- Bioletto F, et al. 2022; 14(4):796.
- Lam K, Schwartz L, Batisti J, Iyer KR. Single-Center Experience with the Use of Teduglutide in Adult Patients with Short Bowel Syndrome. JPEN J Parenter Enteral Nutr. 2018 Jan;42(1):225-230. doi: 10.1002/jpen.1011. Epub 2017 Dec 13. PMID: 29505151.
Источники


ООО «Такеда Фармасьютикалс»
119048, г. Москва, ул. Усачева, дом 2, стр. 1
Тел.: 8 800 700 55 11, факс: +7 (495) 502-16-25
www.takeda.com/ru-ru
Тел.: 8 800 700 55 11, факс: +7 (495) 502-16-25
www.takeda.com/ru-ru

Ваши вопросы —
наши ответы!
Сервис научно-медицинской информации для специалистов здравоохранения

VV-MEDMAT-109727
© 2024 Takeda, все права защищены.
Размещенная информация не является рекомендацией компании Такеда, рекламой компании или ее продукции, не должна быть основанием для принятия каких-либо решений или осуществления каких-либо действий. Решение о выборе метода лечения конкретного пациента должно приниматься лечащим врачом.



Согласно рекомендациям ESPEN, тедуглутид следует применять как препарат первой линии у взрослых пациентов с СКК-КН, которым показана терапия препаратами фактора роста3.




Ramos Boluda E. и соавторы: 12-месячные данные из испанской когорты10
Педиатрические пациенты в возрасте от 1 до 18 лет с синдромом короткой кишки с кишечной недостаточностью (СКК-КН), получавшие тедуглутид (0,05 мг/кг/сут) в течение ≥12 месяцев в Испании.* Длина оставшейся кишки у детей составляла менее 100 см. Зависимость от парентерального питания (ПП). Отсутствие хирургических вмешательств или изменения ПП за последние 3 месяца.
Объем ПП, потери с дефекацией и уровни цитруллина в плазме крови измеряли на исходном уровне и через 3, 6 и 12 месяцев после лечения.
Подход ПП соответствовал критериям Национального руководства по применению.‡
Пациенты, у которых ПП можно было снизить на 20% и более, считались достигшими ответа.
Многоцентровое (n = 8) проспективное наблюдательное когортное исследование.
Эффективность
Результаты оценки эффективности4:
- В группе препарата Тедуглутид было значительно больше ответивших на терапию (62,8%), чем в группе плацебо (30,2%; p = 0,002) на неделе 20 и 24-й
- На 24-й неделе среднее снижение объема ПП/ИТ в группе препарата Тедуглутид составило 4,4 л/нед. (исходный уровень 12,9 л/нед.) по сравнению с 2,3 л/нед. (исходное значение 13,2 л/нед.) в группе плацебо (р <0,001 по сравнению с плацебо)
- На 24-й неделе среднее увеличение по сравнению с исходным уровнем цитруллина, биомаркера массы энтероцитов, было значимо выше при применении препарата Тедуглутид, чем при приеме плацебо (p≤0,0001)
НЯВЛ, связанные с препаратом Тедуглутид, включали:
- Боли в животе (31%)
- Тошноту (29%)
- Осложнения со стороны кишечной стомы (24%)
- Вздутие живота (21%)
- У шести пациентов в группе препарата Тедуглутид отмечена выработка антител против тедуглутида, ни у одного пациента в группе плацебо антител не было выявлено. Эти антитела не были нейтрализующими и не отмечалось признаков уменьшения эффекта препарата на снижение объема ПП/ИТ или других клинически значимых последствий
Безопасность
Число пациентов с нежелательными явлениями (НЯ), серьезными НЯ или НЯ, возникающими во время лечения (НЯВЛ), а также пациентов, прекративших лечение вследствие серьезных НЯВЛ, было сопоставимым между группами лечения5
- В целом, у 83% пациентов, получавших Тедуглутид, наблюдалось 1 НЯ по сравнению с 79%, получавшими плацебо
- Серьезные НЯ были зарегистрированы у 36% по сравнению с 28% пациентов в группе препарата Тедуглутид и плацебо, соответственно
- НЯ привели к прекращению лечения у 2 пациентов в группе лечения препаратом Тедуглутид и у 3 пациентов в группе плацебо, ни одно НЯ не было серьезным
- Чаще всего НЯ при применении препарата Тедуглутид были связаны с нарушениями со стороны желудочно-кишечного тракта
*Из 17 включенных пациентов один пациент (пациент 16) получал лечение в течение в общей сложности 6 месяцев, а один пациент (пациент 17) с ранее существующей гипертрофической кардиомиопатией прекратил лечение через 4 месяца после начала сердечной декомпенсации. Этот пациент возобновил лечение ТЕД через 11 месяцев.
†У одного пациента с детской кишечной псевдообструкцией (PIPO) была сформирована одна стома в проксимальном отделе тощей кишки, и он считался имеющим СКК-КН. У двух пациентов длина оставшейся кишки превышала 100 см, но они зависели от ПП. Ни у одного из пациентов длина не превышала 150 см.
‡Moreno JM, et al. 2017. [на испанском языке]. ПП уменьшили на 10–20%, а энтеральное питание увеличивали, если наблюдалось увеличение массы тела, диурез составлял не менее 25–30 мл/кг/сут, а стул/экскреция стомы были стабильными/уменьшались.
†У одного пациента с детской кишечной псевдообструкцией (PIPO) была сформирована одна стома в проксимальном отделе тощей кишки, и он считался имеющим СКК-КН. У двух пациентов длина оставшейся кишки превышала 100 см, но они зависели от ПП. Ни у одного из пациентов длина не превышала 150 см.
‡Moreno JM, et al. 2017. [на испанском языке]. ПП уменьшили на 10–20%, а энтеральное питание увеличивали, если наблюдалось увеличение массы тела, диурез составлял не менее 25–30 мл/кг/сут, а стул/экскреция стомы были стабильными/уменьшались.
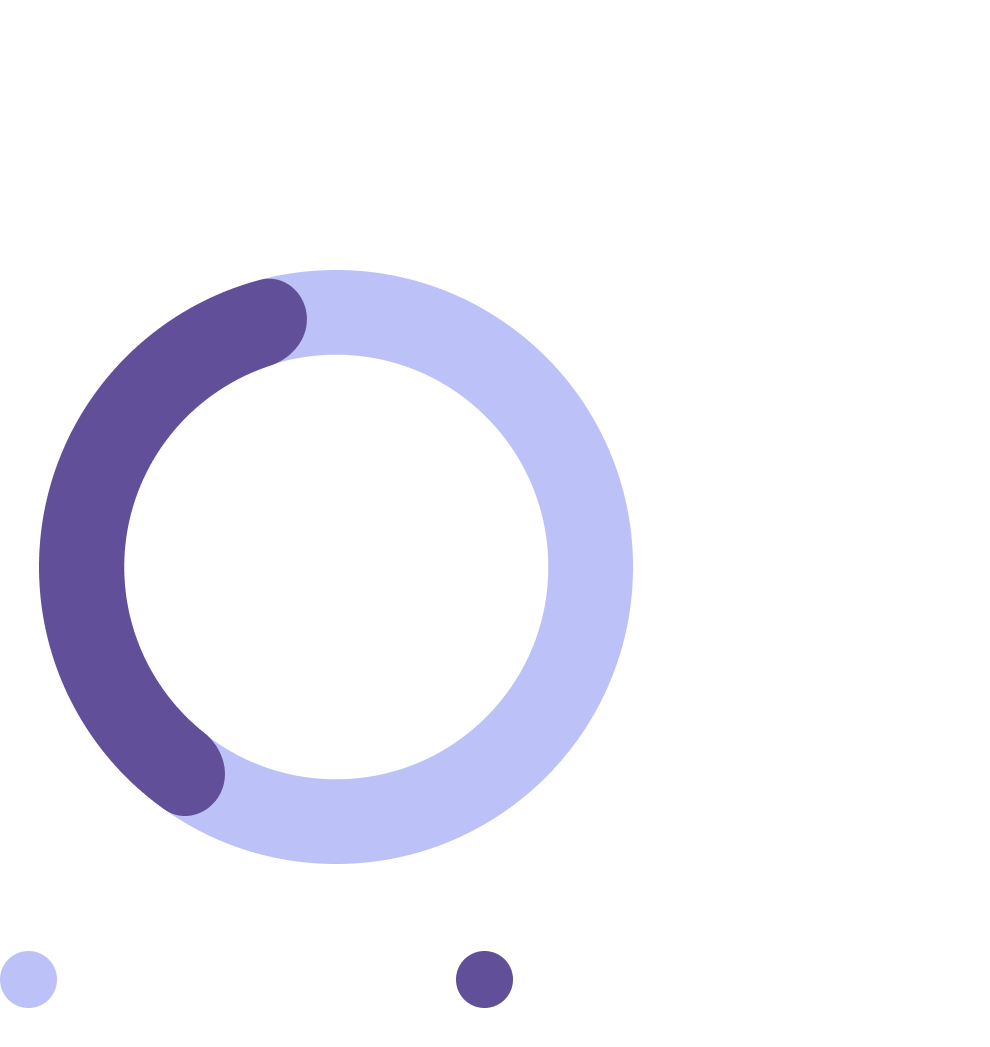
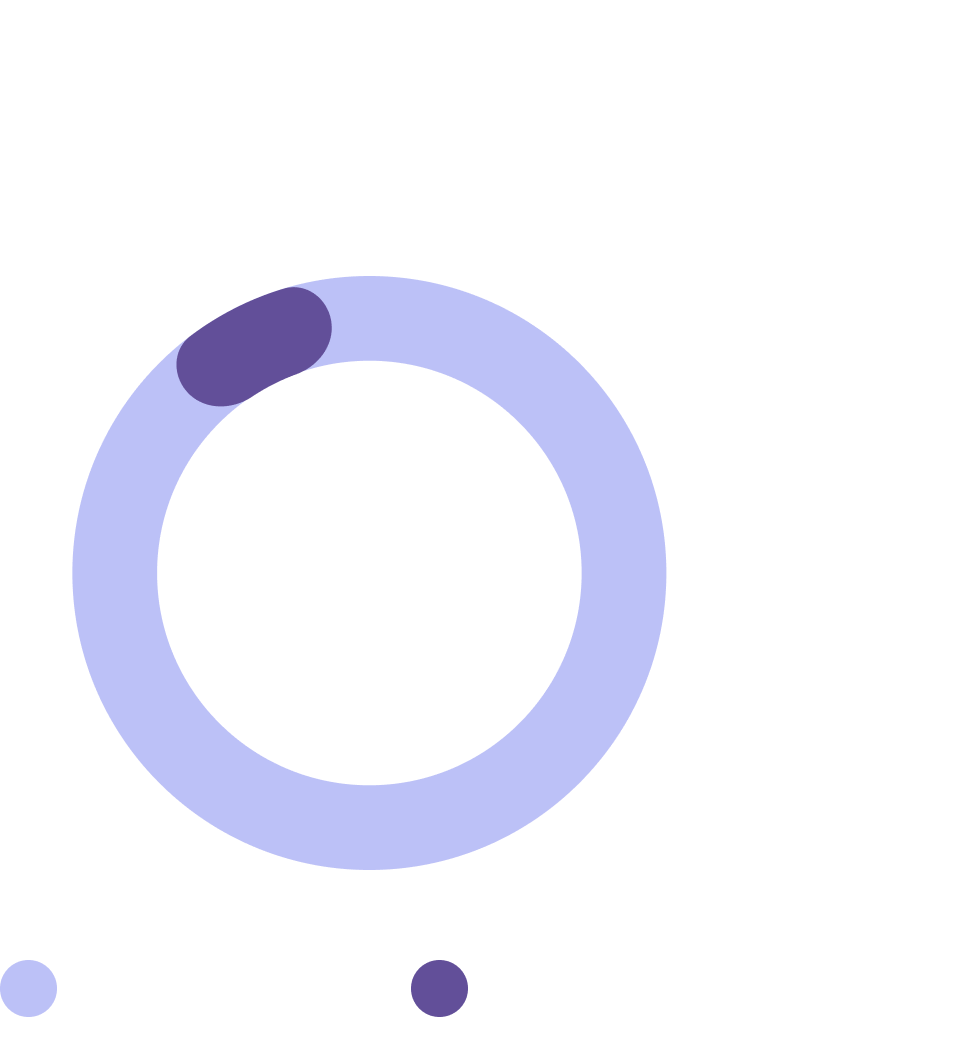
Данные исследования Lam и коллег7
N=18*
Подавляющее количество пациентов имели сохранность толстой кишки в том или ином объеме
Подавляющее количество пациентов имели сохранность толстой кишки в том или ином объеме
СКК — синдром короткой кишки
Клинические исследования препарата Тедуглутид
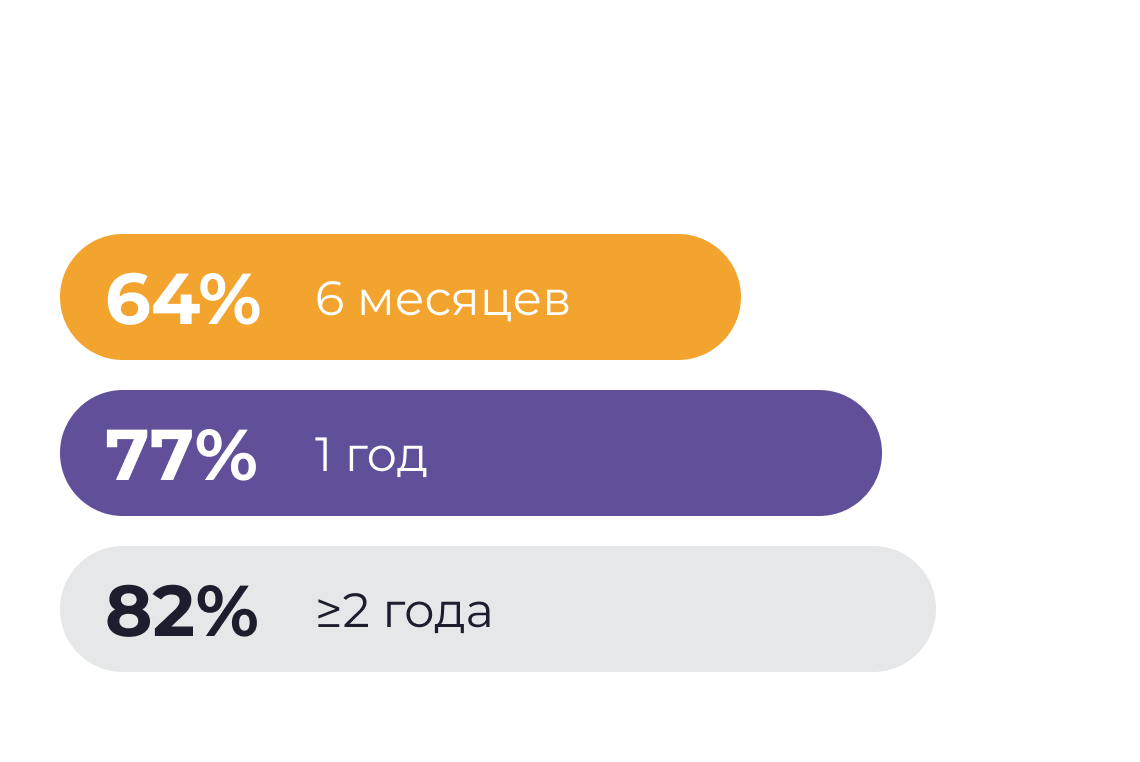
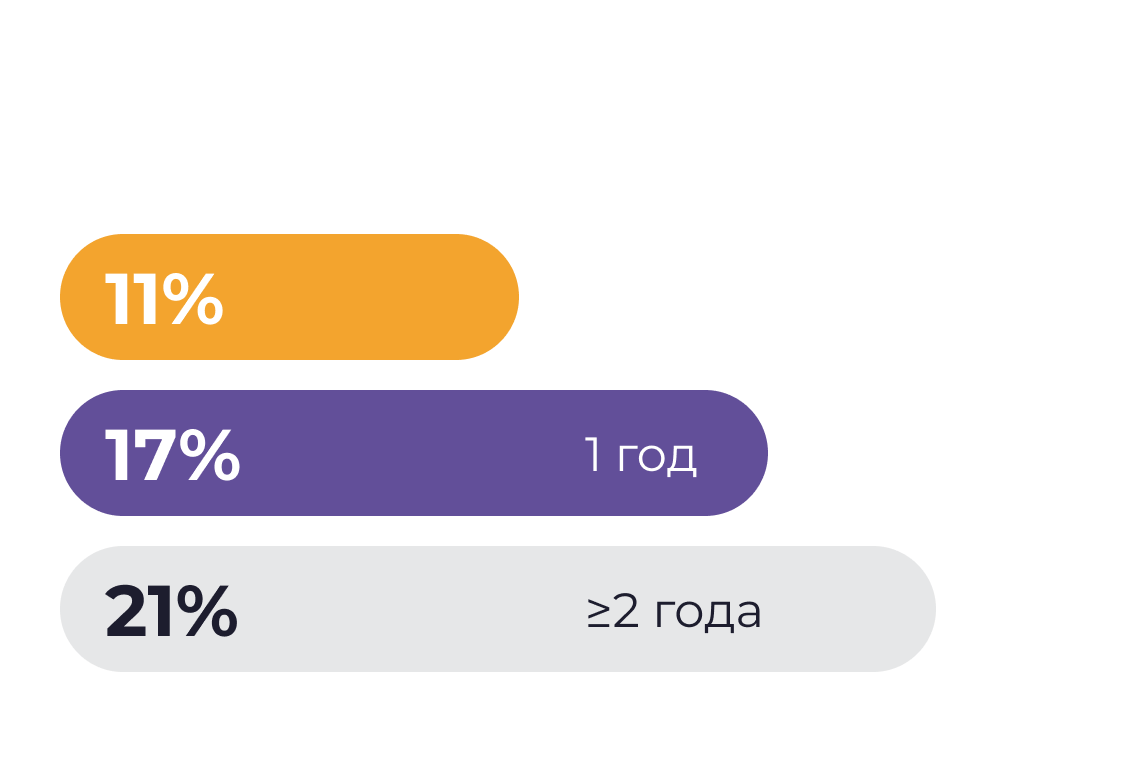
Сохранение толстой кишки — предиктор достижения энтеральной автономии6

